임상시험 분야 종사자 대상, ICH E6(R3) 가이드라인 최신 동향 등 공유
 |
식품의약품안전처(처장 오유경)는 임상시험 종사자를 대상으로 임상시험에 대한 이해도를 높이기 위해 국내·외 임상시험 최신 동향 등을 공유하는 ‘임상시험 관리기준(GCP) 교육 설명회’를 9일 LW컨벤션(서울 중구 소재)에서 개최한다.
임상시험 관리기준(GCP, Good Clinical Practice)은 의약품 임상시험 실시에 필요한 임상시험의 준비, 실시, 모니터링, 점검, 자료의 기록 및 보고 등에 관한 기준.
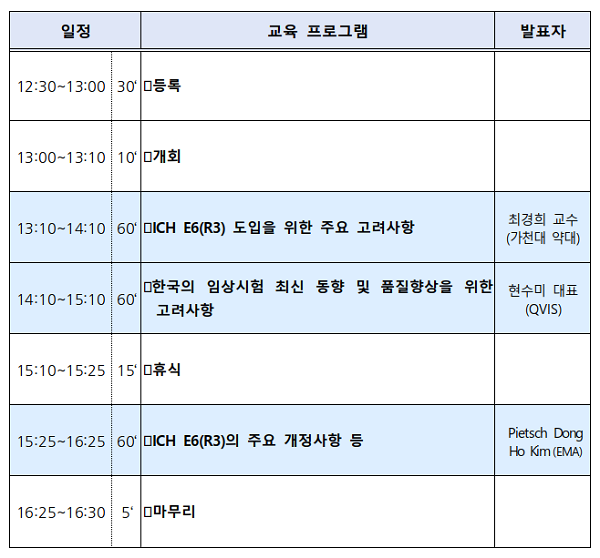
이번 교육에서는 유럽의약품청(EMA) 소속 GCP 조사관 및 학계, 업계 임상시험 분야 전문가가 ▲ICH E6(R3) 가이드라인 주요 개정사항 ▲국내 ICH E6(R3) 가이드라인 도입 시 고려해야 할 사항 ▲임상시험 품질향상을 위한 고려사항과 최신동향에 대해 발표한다.
국제의약품규제조화위원회(ICH)에서는 임상시험 대상자 보호를 강화하고 임상시험 품질을 개선하기 위해 E6(R3) 가이드라인 개정을 추진하고 있다. 식약처도 최신의 가이드라인 내용을 국내에 도입하기 위해 임상시험 관리기준 개선 방안을 논의하고 규제조화를 적극 추진할 예정이다.
식약처는 이번 교육이 임상시험에 대한 국내 종사자의 이해도를 높이고 변화하는 국제 규제 환경에 유연하게 대응할 수 있도록 도움을 줄 것으로 기대하며, 앞으로도 규제과학 전문성을 바탕으로 국내 임상시험의 국제 경쟁력을 높일 수 있도록 최선을 다해 지원할 계획이다.
편집부 dailymedipharmn@gmail.com
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 국민건강보험 일산병원, ‘경기도 북부 아토피·천식 교육정보센터’ 선정
국민건강보험 일산병원, ‘경기도 북부 아토피·천식 교육정보센터’ 선정
